Conductimetría
La ley de Ohm afirma que la corriente i (en Amperes) que pasa por un conductor es directamente proporcional a la resistencia R (en Ohms) del conductor:
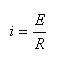
El inverso de la resistencia es la conductancia (G); esta magnitud es medida en inverso de ohm (mho ou Ω-1) y tiene el nombre, recomendado en el SI de Siemens (S). La resistencia de una muestra de material homogéneo, de largo l es área de sección recta a la constante, es dada por:
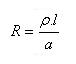
Donde r es una propiedad característica del material, la resistividad. El inverso de la resistividad recibe el nombre de conductividad, cuyo símbolo es k.
La conductancia de una solución electrolítica en cualquier temperatura depende solamente de los iones presentes y de las respectivas concentraciones.
Cuando la solución de un electrolito fuese diluida, la conductancia disminuirá pues los iones presentes, por mililitro de solución, para conducir la corriente eléctrica, estarán en menor número.
Si una solución fuese colocada entre dos electrodos paralelos, separados por 1 cm y suficientemente grandes para contener entre ellos todo el volumen de la solución, la conductancia aumentará a medida que la solución fuese diluída.
Esto se debe en gran parte, a los electrolitos fuertes, la disminución de los efectos interiónicos y en los electrolitos débiles, al aumento en el grado de disociación.
La conductividad molar (Λ) de un electrolito se define como la conductividad debida a un mol y está dada por:
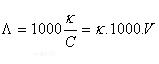
Donde C es la concentración en mol/L y V es la dilución en L (esto es, el número de litros que contienen 1 mol).
En los electrolitos fuertes, la conductividad molar crece cuando la dilución crece, pero parece tender a un valor límite conocido como la conductividad molar a dilución infinita. La magnitud Λ puede ser determinada por la extrapolación gráfica de los datos de conductividad molar de soluciones diluidas de electrolitos fuertes
En el caso de electrolitos débiles, la extrapolación no puede ser utilizada para la determinación de Λ∞, pero es posible estimarla a partir de las conductividades molares en dilución infinita de los respectivos iones, pues en este caso, los iones son independientes unos de los otros y cada cual contribuye con una parte intrínseca para la conductividad total. Entonces:
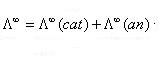
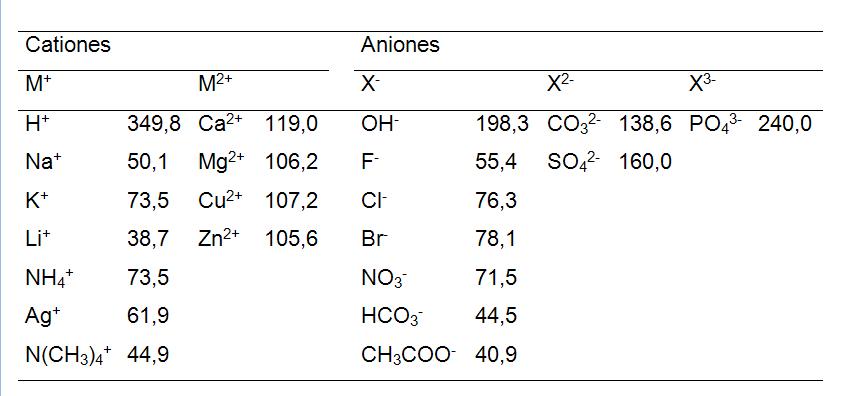
Donde Λ∞ (cat) y Λ∞ (an) son las conductividades molares a dilución infinita del catión y del anión respectivamente. Los valores de las conductividades molares iónicas límites, de algunos iones en agua, a 25ºC están reunidas en la tabla a continuación:
La medida de la conductividad
Se mide la conductividad de una solución colocándola en una célula que dispone de un par de electrodos de platina firmemente fijados en una oposición.
En general es muy difícil medir con precisión el área de los electrodos y el alejamiento entre ellos, de forma que cuando se desean valores exactos de conductividad es necesario determinar la constante de la célula mediante la calibración con una solución cuya conductividad sea conocida con exactitud; por ejemplo soluciones estándar de cloruro de potasio (las soluciones de cloruro de potasio con 7,419138 gr y 0,745236 gr de la sal en 1000 gr de solución tienen, respectivamente las conductividades en Ω-1 cm-1, de 0,0128560 y 0,0014088, a 25ºC).
Las mediciones se hacen por el enlace de la célula a un medidor de conductividad que provee a la célula una corriente alternada con la frecuencia del orden de 1000 Hz. Con la corriente alterna queda reducida la posibilidad de electrólisis, que provocaría la polarización de los electrodos; la corriente alterna sin embargo introduce la complicación de la célula de tener una capacitancia por encima de la resistencia.
Los conductímetros modernos tienen un circuito electrónico apropiado que elimina los efectos de la capacitancia y pueden medir un intervalo amplio de conductividad con dispositivo de elección automática del intervalo de medida.
Mediante la operación de un dispositivo de calibración, el mecanismo es ajustado de forma que el valor de la constante de la célula utilizada aparece en el panel digital que registra los valores de la conductividad.
Al medidor también queda acoplado un medidor de temperatura; ese sensor corrige automáticamente las medidas de conductividad, medidas en un cierto intervalo de temperatura, al valor de 25ºC, que es la temperatura en al cual el aparato está calibrado

