Conceptos de Termodinámica Electroquímica
Para cualquier sistema químico la descripción del estado de equilibrio de cada uno de sus componentes puede ser realizada a través de una magnitud denominada como “potencial químico”. Para el componente j se define el potencial químico (μj) a través de la relación
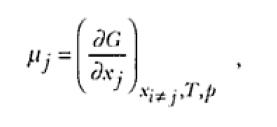
Donde G es la energía libre de Gibbs del sistema y xj la fracción moLar de la especie j. El sistema se encuentra a temperatura T y presión p. La base de esta definición se fundamenta en el hecho de que el potencial químico representa “la variación de energía libre que ocurre (o sea, el trabajo realizado) cuando un mol del componente j es adicionado al sistema, manteniéndose la composición con relación a los demás componentes, a temperatura y a presión constantes”
Si un sistema está en equilibrio, su composición permanece inalterada en función del tiempo, o sea, de acuerdo con los conceptos expuestos, los potenciales químicos de sus componentes no varían con el tiempo y son iguales en cualquier parte del sistema. Caso la última condición no sea satisfecha, las energías libres de los componentes serían diferentes en lugares o fases, lo que llevaría a una evolución de eventos, direccionando el sistema a su estado de menor energía, o sea, el sistema estaría fuera de su estado de equilibrio.
Siendo así, para el componente j presente en dos fases diferentes que forman el mismo sistema (fase α y fase β), el equilibrio estará descrito por la igualdad
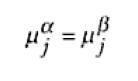
Para las dos fases que forman la interfase electrodo solución electrolítica, la descripción del equilibrio debe considerar la presencia de los campos eléctricos allí existentes. De esta forma, la descripción del equilibrio debe ser realizada a través del concepto más completo denominado como potencial electroquímico. Para una cierta especie iónica j con valencia z, el potencial electroquímico se relaciona con el potencial químico a través de la ecuación
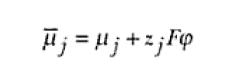
Donde F es la constante de Faraday y φ es el potencial eléctrico al cual la especia estará sometida. Así, el potencial electroquímico tendrá un significado semejante al del potencial químico expresado, con la diferencia de que también los componentes del trabajo eléctrico son incluidos en el trabajo total. La descripción del equilibrio en términos de potencial electroquímico es análoga a la anterior, o sea, para un sistema en que las fases α y β están en contacto entre si,
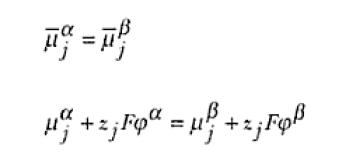
de donde se puede obtener:
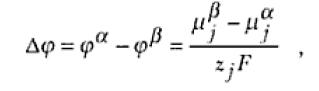
Siendo que Δφ representa la diferencia de potencial eléctrico existente entre las fases α y β. La ecuación anterior es la definición termodinámica de la diferencia de potencial. En un sistema electroquímico, si las fases α y β fuesen el metal del electrodo y la solución electrolítica, respectivamente, Δφ representará la diferencia de potencial galvánico de interfase electrodo/solución.
El potencial químico de una especie en un determinado sistema es función de su concentración expresada en términos de la fracción molar. Para soluciones ideales se puede describir como:
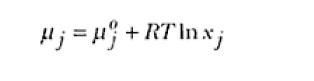
Donde μ0j es el potencial químico de la especie j en su estado estándar que en este caso corresponde al componente puro (o sea, x = 1).
Para otra escala de concentración, un nuevo estado estándar deberá ser definido. Por ejemplo si la escala molar (m) fuese empleada, el estado estándar corresponderá a la situación en que m = 1 que, obviamente, no es aquel correspondiente al componente puro.
En soluciones no ideales la concentración de la especie no puede ser directamente empleada para el cálculo del potencial químico. Para estos casos se emplea una escala termodinámica de concentración denominada de actividad y simbolizada para el caso de la especie j como αj. Entonces, la expresión del potencial químico para los sistemas reales tendría la forma :
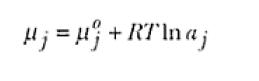
siendo por lo tanto, el estado estándar aquel correspondiente a la situación en que la actividad del componente es unitaria. La correlación entre las escalas termodinámicas y convencionales de concentración es realizada en términos de un coeficiente de actividad γ de tal forma que, para la escala de fracción molar,
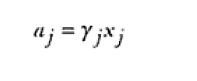
Siendo que γj resulta función de xj. Así, para calcular los valores de αj y a partir de estos, los valores de los potenciales químicos, los correspondientes valores de γj deben ser reconocidos.
Una forma de obtenerse los coeficientes de actividad es a través de la teoría de Debye-Huckel. Para soluciones diluidas (concentraciones del orden de o menores que 0,001M) de un electrolito univalente, se puede emplear la siguiente relación obtenida a partir de la teoría de Debye-Huckel:
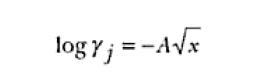
Donde A es una constante dependiente apenas de la constante dieléctrica del solvente y de la temperatura. Para el agua a 25ºC, A≡ 0,507.

