Conceptos de Isomería
Isómeros son compuestos que poseen fórmulas moleculares iguales, pero propiedades químicas diferentes, debido a las fórmulas estructurales diferentes.
El fenómeno de la isomería en la Química, es semejante al fenómeno de la existencia de palabras diferentes por la permutación de las letras, como por ejemplo: AMOR y ROMA (mismas letras, “iguales” fórmulas moleculares; diferentes acomodaciones “diferentes” fórmulas estructurales)
La isomería se divide en isomería plana e isomería espacial
Isomería Plana
Los isómeros presentan la misma fórmula molecular, pero diferentes fórmulas planas.
Se dividen en:
Isomería de Cadena
Los isómeros tienen cadenas carbónicas diferentes
Ejemplos:
a) Cadena abierta vs Cadena Cerrada:
![]()
b) Cadena normal vs. Cadena ramificada:
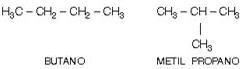
c) Cadena homogénea vs. cadena heterogénea:

Isomería de Posición
Los isómeros tienen la misma cadena carbónica, pero difieren por la posición de radicales, enlaces dobles o triples.
Ejemplos:
a) Diferente posición del radical
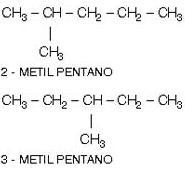
b) Diferente posición de un grupo funcional:
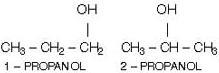
c) Diferente posición de una insaturación
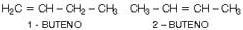
En este caso, es importante poner bastante atención en el ejemplo a continuación, observemos:
HO – CH2 – CH2 – CH3
Isomería Óptica
Los compuestos que poseen la misma fórmula molecular, sin embargo presentan diferentes actividades ópticas son llamados isómeros ópticos.
Actividad Óptica
Observa la figura a continuación
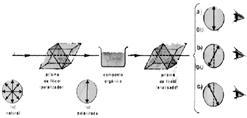
Cuando la luz prolongada (luego de pasar por el prisma de Nicol – polarizador) atraviesa el compuesto orgánico en análisis, observamos los siguientes resultados:
En el caso “a” la luz polarizada que vibraba en un determinado plano, al atravesar el compuesto orgánico, continuó vibrando en el mismo plano. Decimos entonces que el compuesto en cuestión no tiene actividad sobre la luz, entonces él es ópticamente inactivo.
En el caso “b”, la luz polarizada, luego de atravesar el compuesto orgánico, pasó a vibrar en un plano a la derecha de aquel en el que vibraba anteriormente. Por tanto el compuesto es ópticamente activo. Por haber girado el plano de la luz polarizada hacia la derecha, decimos que es “dextrógiro”
En el caso “c”, luego de atravesar el compuesto orgánico, la luz polarizada pasó a vibrar en un plano a la izquierda del original. Concluimos entonces que el compuesto es ópticamente activo.
Por haber girado el plano de la vibración de la luz polarizada hacia la izquierda, decimos que es “levógiro”.
La actividad óptica de un compuesto está relacionada directamente con la asimetría de sus moléculas
Molécula asimétrica es la que nunca se logra dividir de forma que los dos lados resultantes de esa división sean iguales.
Esa asimetría molecular puede ser expresada de dos formas: presencia de carbono asimétrico y asimetría molecular propiamente dicha (sin carbono asimétrico)
Isomería Óptica con Carbono Asimétrico
Carbono asimétrico (o quiral) es aquel que posee cuatro enlazantes, todos diferentes entre si
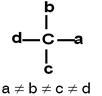
Un ejemplo común es el ácido láctico (ó ácido alfa – hidroxi – propanoico), que proviene desde la leche.
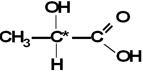
Ácido 2- hidroxi – propanoico o ácido láctico

