Cinética del Proceso de creación de complejos
Las moléculas de agua poseen propiedades de enlace, pues presentan pares de electrones no compartidos.
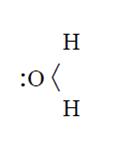
Cuando cationes metálicos, que poseen habilidad de formar complejos, son colocados en agua ellos no se quedan en la forma de iones simples
![]()
Pero forman iones complejos acuosos, representados por la fórmula general:
![]()
El proceso de formación de un nuevo complejo, cuando otros enlazantes son introducidos, no debe ser considerado como un proceso directo de enlace entre el catión metálico y los enlazantes que están presentes, más si como un proceso de sustitución de las moléculas de agua (enlazantes) del complejo acuoso por los enlaces más estables.
Ejemplo: Cuando Cu2+ es colocado en agua, el permanece en la forma de un complejo acuoso
[Cu(H2O)4]2+
Cuando amoníaco (NH3) es gradualmente adicionada en esta solución, las moléculas de agua del complejo acuoso son sustituidos por las moléculas de amoníaco, con la formación primero de un complejo de agua-amoníaco, luego de un complejo de amoníaco:
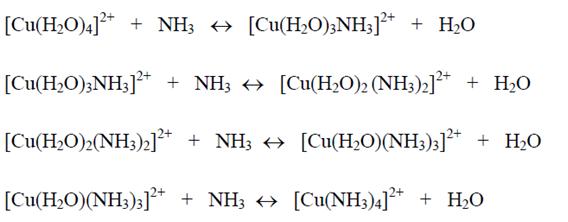
De esta forma, cualquier complejo se transforma gradualmente en otro más estable.
La sustitución de un enlazante por otro, conjuntamente al átomo metálico, puede ocurrir en diferentes velocidades, lo que permite clasificar los complejos en lábiles, cuando la sustitución de enlazantes ocurre rápidamente, o inertes cuando la sustitución es lenta.
Para ser considerado lábil, el intercambio de enlazantes en un complejo tiene que suceder en un tiempo inferior a un minuto, a 25 ºC y en solución 0,1 M (por convención).
La mayoría de los complejos, incluyendo los acuosos son lábiles.
Esta constante define la relación entre la concentración del ion complejo del metal y las concentraciones de los iones metálicos y de los enlazantes libres en la solución. Consecuentemente, cuanto mayor el valor de K, mayor la estabilidad del complejo del metal.
Cuando se trata de la formación de complejos involucrando sucesivas etapas de reacción, como en el ejemplo a continuación:
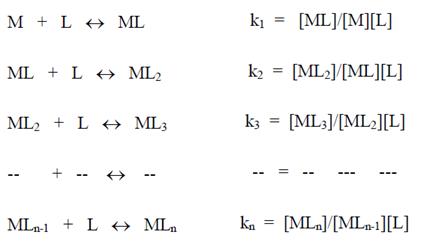
Las constantes k1, k2, k3, kn, son conocidas como “constantes de formación parciales” y el producto de ellas es la “constante de formación absoluta o total”.
Combinando por multiplicación todas las ecuaciones de arriba se obtiene:
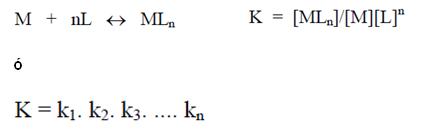
Donde k = constante de estabilidad o constante de formación del complejo.
Factores que influencian en el equilibrio – Efecto del pH sobre el equilibrio metal-complejo
Muchos agentes complejantes y quelantes son bases de Lewis (eso es, capaces de donar pares de electrones) y también bases de Brönsted (esto es, capaces de recibir protones) y consecuentemente, serán afectados por los cambios en el pH.
La reacción quelatométrica es influenciada por el pH, porque el agente quelante no se presenta totalmente en la forma de ion quelante libre, o sea, los iones hidrógeno compiten con el ion metálico en la quelación.
Así, la formación de un complejo puede ser descrita por la ecuación (1):
![]()
Para la cual la expresión de equilibrio es (2):
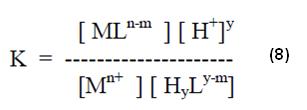
La cual también puede ser interpretada, separadamente de la siguiente forma (3)
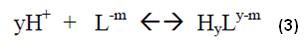
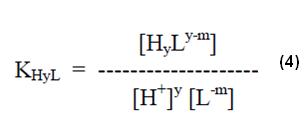
Y
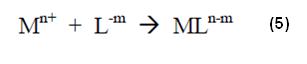
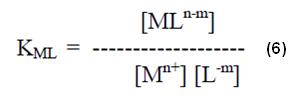
Dividiendo la expresión (6) por la (4) tendremos:
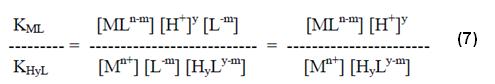
De donde, comparándose con la ecuación de KH y L (4), se puede extraer que:
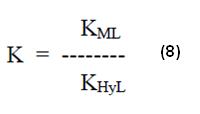
Donde KH y L es la constante de estabilidad del complejo con el protón (también llamado constante de ionización para el caso de los aminopolicarboxílicos).
En tanto, cada etapa de ionización del ácido aminopolicarboxílico es definida por una constante de ionización.

Como resultado de esta basicidad (tendencia a reaccionar con los protones) que los iones quelantes L presentan es que la formación del complejo es función del pH.
Así, la constante de formación aparente o constante de estabilidad efectiva de un complejo en determinado pH, puede ser deefinida por la expresión:
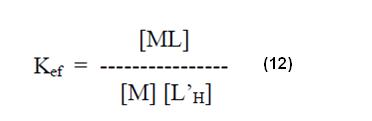
Donde [L’H] indica la concentración total del agente quelante no enlazado al metal, en determinado pH. De esa forma se tiene para la concentración total de [L’H] :
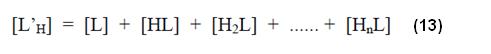
Sustituyendo los valores [HL], [H2L] etc., por los valores dados por las constantes parciales de ionización (9) a (11) se obtiene:
![]()
Sin embargo el término [L’H] también puede ser obtenido de la expresión:
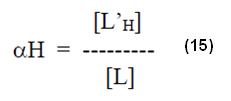
Donde αH es el cociente entre la concentración total del agente quelante no enlazado al metal en determinado pH es la concentración total del agente quelante.
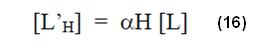
Sustituyendo el valor de la ecuación (16) en (14), se tiene:
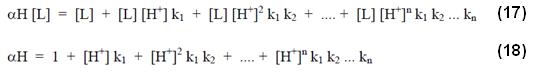
Se puede con el auxilio de las expresiones presentadas, extraer el valor de la constante de estabilidad aparente a un determinado pH siendo como:
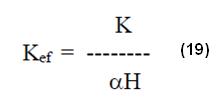
Donde K es la constante de estabilidad absoluta.

