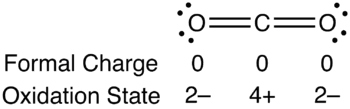Carga formal
La carga formal de un átomo que participa en un enlace covalente es la carga que tendría el mismo si no hubiera diferencias de electronegatividad entre los átomos que forman en enlace, es decir, si los electrones se compartieran por igual. Explicado con otras palabras, sería la carga con que quedaría el átomo si el enlace se rompiera homolíticamente.
La carga formal de un átomo en una molécula se calcula restando: número total de electrones de valencia menos número de electrones que no participan del enlace (pares libres) menos la mitad de los electrones compartidos en el enlace covalente.
Ejemplos
- Carbono en metano (CH4). Como todos los electrones de valencia del carbono están participando de enlaces covalentes, la carga formal es cero. 4 – (0 + 4)= 0
- Nitrógeno en la molécula nitro (NO2).Carga formal 5 – (1+3)= 1.
Estudiemos más a fondo el ejemplo del amonio NH4+. En esta molécula, la carga formal del nitrógeno sería 5-(0+4)= 1. Las cargas formales de los átomos de hidrógeno son de cero. Por lo tanto en toda la molécula, la suma de las cargas formales de los átomos que la componen es 1, valor coincidente con la carga positiva del catión.
Veamos el caso de la molécula de CO2. Esta molécula tiene 16 electrones de valencia, cuatro aportados por el carbono y seis por cada átomo de oxígeno. El carbono se podría unir mediante enlaces simples a los átomos de hidrógeno, con carga formal 0 para la molécula, pero con carga formal de +2 para carbono y -1 para cada oxígeno. Si fuera un enlace simple y uno doble, la carga formal de la molécula seguiría siendo cero, con carga +1 para el carbono, 0 para el oxígeno de doble enlace y -1 para el enlace simple. En el caso de unirse el carbono mediante enlaces dobles a los dos átomos de oxígeno, la carga formal de la molécula y de los tres átomos sería cero. Es por esto que esta última estructura es la prevalente, porque las cargas formales siempre tienden a ser cero o lo más cercanas a cero que sea posible en todos los átomos.
Siempre debemos tener en cuenta que la carga formal es sólo eso, una formalidad, que resulta útil para contar los electrones que se han aportado para el enlace, pero en la realidad estos electrones pueden hallarse atraídos por otro átomo, de mayor electronegatividad.
Carga formal y estado de oxidación.
Cuando asignamos cargas formales a átomos que están enlazados covalentemente, lo hacemos suponiendo que los electrones que forman el enlace se comparten, es decir se reparten en partes iguales entre los átomos. En cambio, cuando asignamos cargas a un átomo según su estado de oxidación, se toma en cuenta el átomo de mayor electronegatividad, y se le “otorgan” los electrones del enlace a dicho átomo.
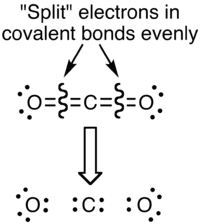
En la figura que sigue, observamos cómo quedarían dispuestos los electrones en una eventual ruptura homolítica de los enlaces en la molécula de CO2
Desde la perspectiva del estado de oxidación, la disposición de los electrones en una eventual ruptura de los enlaces de la misma molécula seria:
En la carga formal se toma en cuenta la repartición total de los electrones del enlace, mientras que en el estado de oxidación se toma en cuenta que el átomo de mayor electronegatividad “robará” los electrones para sí. La disposición real de los electrones en la molécula sería un estado intermedio entre estas dos disposiciones. Los electrones se encuentran más cerca del átomo más electronegativo, sin “llevárselos” totalmente, o sea compartiéndolos parcialmente.
Para explicar la posición real de estos electrones, fueron ideadas las teorías del enlace de valencia y de los orbitales moleculares.